聚焦聚集体去除|疏水层析在双特异性抗体纯化中的应用
引言|双特异性抗体的挑战与机遇
双特异性抗体(bispecific antibodies, bsAbs)是人工工程化的免疫球蛋白,能够同时识别同一抗原或不同抗原上的两个表位。它们的双重靶向能力使其比传统单抗更具优势,在药物治疗中具有显著前景。
首个双抗产品于2009年获批上市——卡妥索单抗(catumaxomab),靶向CD3与EpCAM,用于恶性腹水治疗。虽然该药于2013年退市,但此后双抗研发迅猛发展。到2023年,全球已有超200种双抗分子正在进行300多项临床试验,其中约75%针对实体瘤,25%针对血液恶性肿瘤。截至2024年底,已有19款双抗药物获批上市。
从结构上看,双抗可分为不含Fc区(Non IgG-like BsAb)与含Fc区(IgG-like BsAb)。后者又细分为对称型与非对称型,其中非对称型包含四条不同链(两种HC与两种LC),极易出现链错配,产生大量副产物。即使通过工程手段(如knobs-into-holes、CrossMab)部分缓解错配,仍难完全消除。对称型虽副产物较少,但聚集体明显增多,这可能是因为链长增加和柔韧性增强而导致的分子间结构域交换形成的。因此,高效去除错配产物与聚集体等杂质成为双抗下游纯化的关键挑战。
疏水层析在双抗纯化中的应用
疏水相互作用层析(Hydrophobic Interaction Chromatography, HIC)因其在抗体生产中能有效去除聚集体,广泛应用于下游工艺。
其原理为:根据蛋白表面疏水性差异,利用蛋白和疏水层析介质疏水表面可逆的相互作用来分离蛋白。
工艺模式:结合-洗脱 or 流穿
结合-洗脱模式:选择疏水性合适的的介质,样品中加入高盐,蛋白结合,降低盐浓度洗脱,分离目的蛋白和杂质。
流穿模式:选择具有高疏水性的介质,不向样品中加入盐或者加入低盐,目的蛋白流穿,杂质结合。
案例:添加剂改善疏水层析分辨率
以下为IgG4型双抗(Fc区引入ScFv)的HIC优化实验:Load SEC为85.6%,HCP 36 ppm
表1.优化后疏水层析分离效果总结
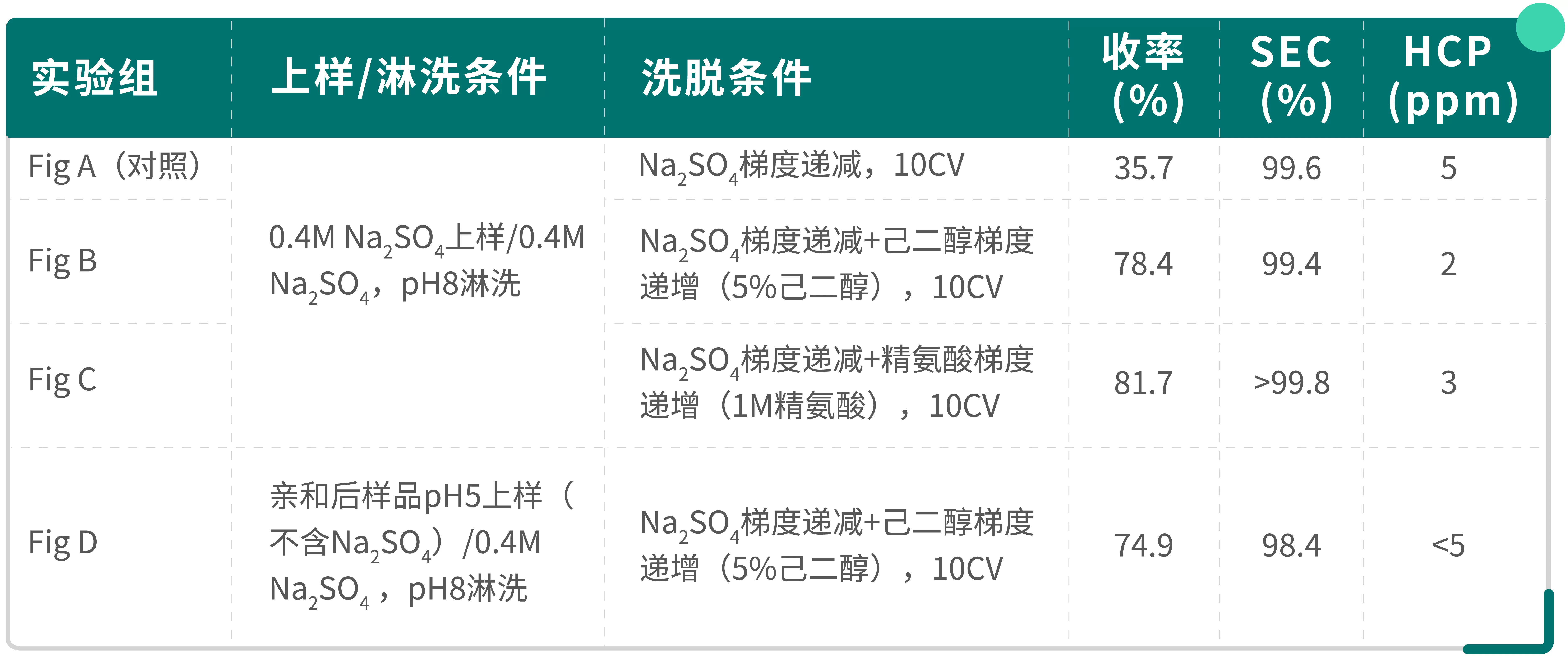

Fig.1 己二醇和精氨酸洗脱梯度对疏水介质的分离曲线的影响
结果显示:
己二醇、精氨酸能显著提升纯度与回收率。可能的原因在于己二醇、精氨酸可以改善溶液极性,降低疏水相互作用、稳定蛋白构象以及优化洗脱动力学,从而提高了介质选择性。但在实际应用中需同时考虑添加剂的风险以及去除。从本实验可知,疏水层析也可通过简化疏水层析上样条件,降低工艺复杂性。
疏水介质选择与优化建议
疏水介质选择需综合考虑配基的疏水性、配基的密度、介质的基质等;可依据如下表所示选择合适疏水介质
• 配基疏水性强弱:Butyl-S<Butyl<Octyl<Phenyl
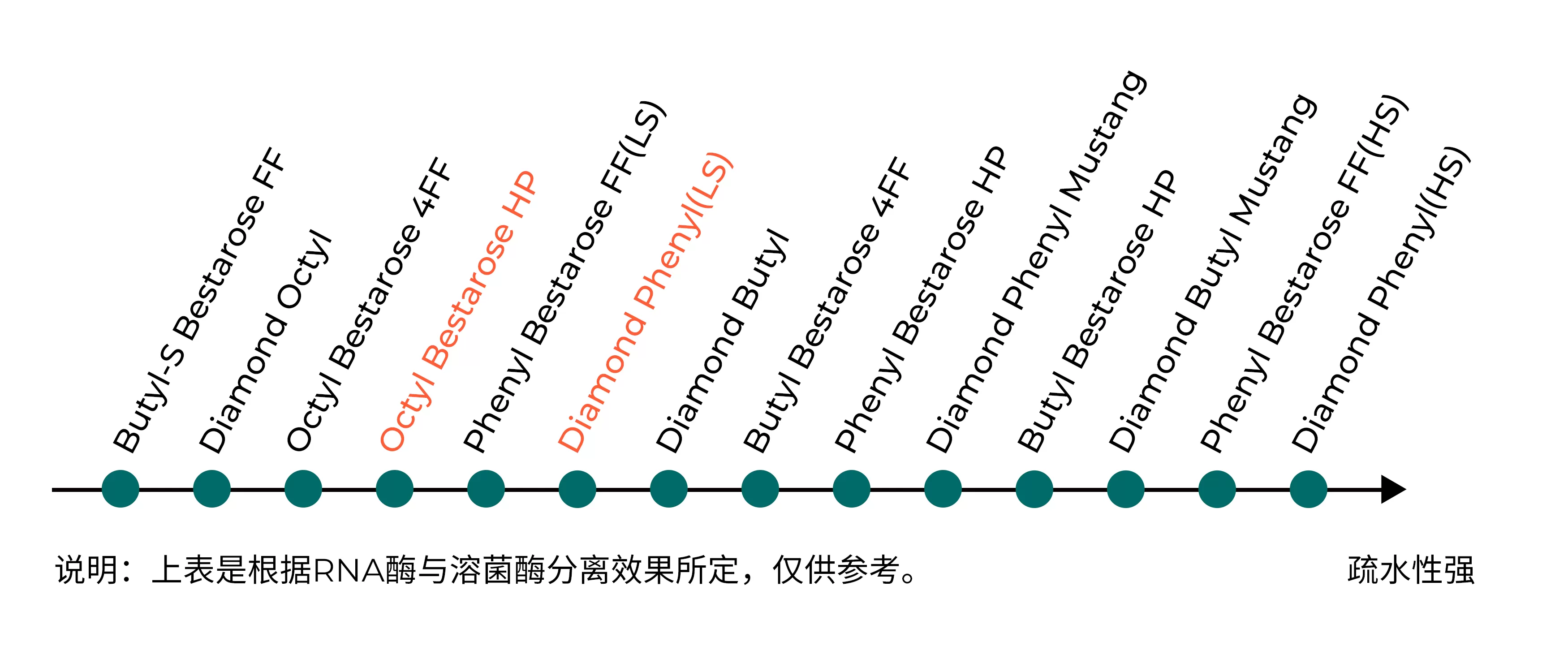
Fig.2 疏水层析介质疏水性强弱顺序表
• 粒径影响分辨率:HP系列(34μm)>Mustang系列(40μm)>FF系列(90μm)
• 缓冲液种类的选择:正确选择盐的种类和浓度是影响载量和选择性的重要参数。最常用的盐溶液是硫酸铵(2M以内,pH不高于8.0)、硫酸钠、氯化钠等。不同的盐对蛋白与疏水介质结合的影响如下顺序:
Na2SO4 > (NH4)2SO4 > NaCl > NH4Cl > NaBr > NaSCN
• 离子强度的选择:不同的离子强度表现出不同的选择性,由于离子强度决定样品的结合力,故随着盐浓度的增加,结合力增加,蛋白载量增加,但可能会导致蛋白结合太强或者蛋白沉淀,无法洗脱;而过低的盐浓度会使蛋白无法结合。对于未知蛋白,初次实验推荐结合缓冲液:50mM PBS pH7.0,1-1.5M硫酸铵,洗脱缓冲液:50mM PBS pH7.0,可根据该次实验结果,调整离子强度。
• 添加剂选择:水溶性醇、去垢剂(改善溶液极性,减少水的表面张力,减弱相互作用导致蛋白解离,如己二醇、异丙醇等)、离序性盐(降低溶液疏水效果,从而减弱疏水相互作用导致蛋白解离,如CaCl2、MgCl2)。
• 温度控制:因疏水作用为熵驱动,因而随着温度的升高,疏水相互作用增加,范德华力增加,从而导致蛋白结合变紧,故实验需谨慎控制温度。
小结
疏水层析作为双抗纯化中的关键步骤,在去除聚集体等方面展现出独特优势。通过选择合适的介质类型,优化工艺参数,可实现目标分子与杂质的高效分离,实现高纯度、高收率目标,助力双抗纯化工艺产业化落地。
参考文献
[1] Klein, Christian, et al. "The present and future of bispecific antibodies for cancer therapy." Nature reviews Drug discovery 23.4 (2024): 301-319.
[2] Li, Yifeng , et al. "A roadmap for IgG-like bispecific antibody purification." Approaches to the Purification, Analysis and Characterization of Antibody-Based Therapeutics (2020).
[3] Hall, Troii. , G. M. Kelly , and W. R. Emery . "Use of mobile phase additives for the elution of bispecific and monoclonal antibodies from phenyl based hydrophobic interaction chromatography resins." Journal of chromatography. B, Analytical technologies in the biomedical and life sciences 1096(2018):20-30.
[4] Chen, Serene W , and W. Zhang . "Current trends and challenges in the downstream purification of bispecific antibodies." Antibody Therapeutics 4.2(2021).
[5] Andrews, A. T. . "Protein purification principles, high resolution methods and applications." Food Chemistry (1991).
.png)


